1.
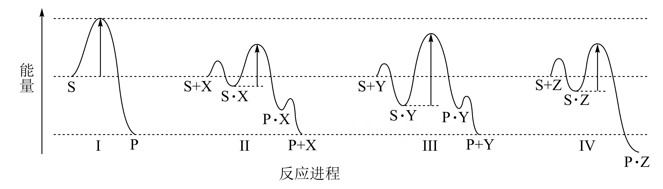
高能固氮反应条件苛刻,计算机模拟该历程如图所示,在放电的条件下,微量的O2或N2裂解成游离的O或N原子,分别与N2和O2发生以下连续反应生成NO。下列说法错误的( )

A.
图1中,中间体1到产物1的方程式为O-O═N→O+N═O
B.
NO的生成速率很慢是因为图2中间体2到过渡态4的能垒较大
C.
由O和N2制NO的活化能为315.72kJ•mol-1
D.
由N和O2制NO的过程比由O原子和N2制NO的过程速率慢
【考点】
活化能及其对化学反应速率的影响;
基础巩固
能力提升
变式训练
拓展培优
真题演练