1.
 和CO是常见的环境污染气体。
和CO是常见的环境污染气体。
(1)
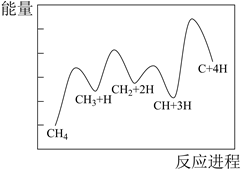
对于反应 来说,“
来说,“ ”可作为此反应的催化剂。其总反应分两步进行:第一步为
”可作为此反应的催化剂。其总反应分两步进行:第一步为 ;则第二步为(写方程式)。已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能(填“大于”“小于”或“等于”)第二步反应的活化能。
(2)
在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:
;则第二步为(写方程式)。已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能(填“大于”“小于”或“等于”)第二步反应的活化能。
(2)
在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应: , 容器Ⅰ、Ⅱ、Ⅲ中
, 容器Ⅰ、Ⅱ、Ⅲ中 的平衡转化率如图乙所示:
(3)
采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现
的平衡转化率如图乙所示:
(3)
采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现 电催化还原制备甲醇方向取得重要进展,该反应历程如图所示:
电催化还原制备甲醇方向取得重要进展,该反应历程如图所示:

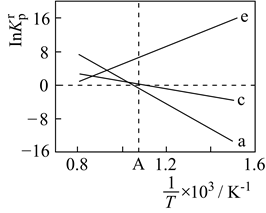
①该反应的(填“>”或“<”)0。
②若容器Ⅰ的体积为 , 反应在370℃下进行,
后达到平衡,则
内容器Ⅰ中用
表示的反应速率为,B点对应的平衡常数
(保留两位有效数字)。
③图中A、C、D三点容器内气体密度由大到小的顺序是。
④若容器Ⅳ体积为 , 反应在370℃下进行,则起始时反应(填“向正反应方向”“向逆反应方向”或“不”)进行。

容易得到的副产物有CO和 , 其中相对较少的副产物为;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中 (填字母)的能量变化。
A. B.
C. D.
【考点】
活化能及其对化学反应速率的影响;
化学平衡常数;
能力提升
真题演练