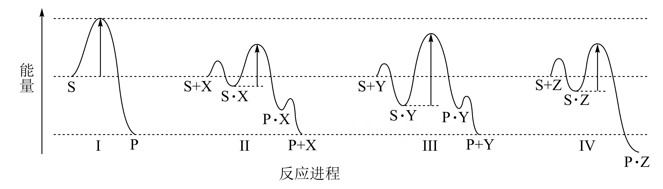
1.
已知:MnO4﹣在酸性环境下的还原产物是Mn2+ . 某化学兴趣小组的甲同学在向草酸(弱酸)溶液中逐滴加入高锰酸钾溶液时,发现溶液褪色总是先慢后快,即反应速率由小变大.为此,他对此实验进行了探究.
【实验用品】
试剂:0.1mol•L﹣1 H2C2O4溶液、0.1mol•L﹣1 KMnO4溶液、稀硫酸、MnSO4固体
仪器:试管(若干个)、胶头滴管(2支)
【实验内容】
在1号和2号试管中分别加入10mL H2C2O4溶液和少量稀硫酸,在1号试管中加入硫酸锰固体.然后在两支试管中加入0.1mol•L﹣1 KMnO4溶液.现做如下对比实验,现象如下表所示:
加入药品 | 不加MnSO4的 稀硫酸酸化的 H2C2O4溶液 | 加少量MnSO4的 稀硫酸酸化的 H2C2O4溶液 |
实验现象 (褪色时间) | 溶液褪色很慢 (31秒) | 溶液褪色很快 (4秒) |
请回答下列问题.
(1)甲同学进行该实验还缺少的实验仪器是 .
(2)H2C2O4溶液与酸性KMnO4溶液反应的离子方程式为 .
(3)甲同学认为该反应褪色由慢到快是何种原因引起的? .
(4)乙同学从甲同学的实验探究中得到启示,他也提出了可能影响该化学反应速率的因素,你认为他提出的因素可能是 (写一条即可).
【考点】
活化能及其对化学反应速率的影响;
能力提升
变式训练
拓展培优
真题演练