1.
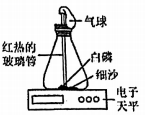
某同学按下图所示装置对质量守恒定律进行实验探究,观察到反应中有气体生成,反应后天平不平衡,由此得出这个化学反应不遵守质量守恒定律。这个结论是否正确?

为什么?
【考点】
验证质量守恒定律;
基础巩固
能力提升
变式训练
拓展培优
真题演练




 B
B 
 D
D 



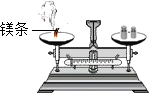
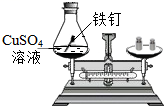
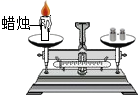
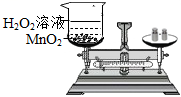








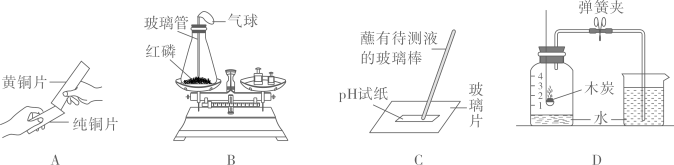
 测定空气中氧气的含量
测定空气中氧气的含量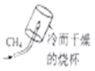 探究甲烷中是否含碳元素
探究甲烷中是否含碳元素 验证质量守恒定律
验证质量守恒定律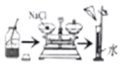 配制一定溶质质量分数的氯化钠溶液
配制一定溶质质量分数的氯化钠溶液