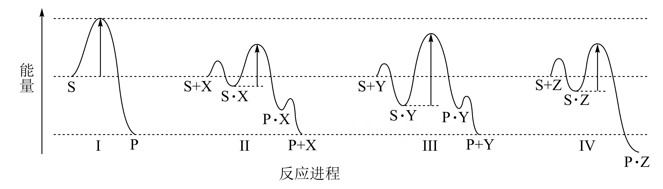
1.
在一定温度下,M、N能在溶液中发生反应生成P和Q:  。
。
A.将0.2 mol·L-1 M溶液和0.2 mol·L-1 N溶液各20 mL混合
B.将0.5 mol·L-1 M溶液和0.5 mol·L-1 N溶液各50 mL混合
C.将1 mol·L-1 M溶液和1 mol·L-1 N溶液各10 mL混合,同时倒入30 mL蒸馏水
D.将1 mol·L-1 M溶液20 mL和1.2 mol·L-1 N溶液60 mL混合
反应开始时,反应速率由大到小的顺序是。
【考点】
化学反应速率的影响因素;
基础巩固
能力提升
变式训练
拓展培优
真题演练