1.
 捕获和转化可减少
捕获和转化可减少 排放并实现资源利用,原理如图1所示。反应①完成之后,以
排放并实现资源利用,原理如图1所示。反应①完成之后,以 为载气,以恒定组成的
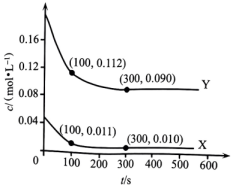
为载气,以恒定组成的 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 , 在催化剂上有积碳。
, 在催化剂上有积碳。

下列说法错误的是( )
A.
反应①为 ;反应②为
;反应②为 B.
B.
 ,
,  比
比 多,且生成
多,且生成 速率不变,可能有副反应
速率不变,可能有副反应 C.
C.
 时刻,副反应生成
时刻,副反应生成 的速率大于反应②生成
的速率大于反应②生成 速率
D.
速率
D.
 之后,生成
之后,生成 的速率为0,是因为反应②不再发生
的速率为0,是因为反应②不再发生
【考点】
化学反应速率;
化学反应速率的影响因素;
化学平衡的影响因素;
基础巩固
能力提升
变式训练
拓展培优