1.
已知反应CO(g)+H2O(g) 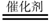 CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
A.
升高温度,K减小
B.
减小压强,n(CO2)增加
C.
更换高效催化剂,α(CO)增大
D.
充入一定量的氮气,n(H2)不变
【考点】
化学平衡的影响因素;
能力提升
变式训练
拓展培优
真题演练








