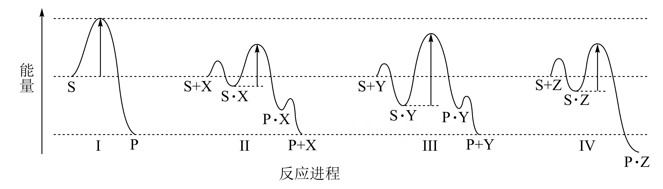
1.
在一密闭容器中充入1 mol H2和1 mol I2 , 压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)=2HI(g)
(1)保持容器容积不变,向其中充入1 mol H2 , 反应速率。
(2)升高温度,反应速率。
(3)扩大容器体积,反应速率。
(4)保持容器内气体压强不变,向其中充入1 mol H2(g)和1 mol I2(g),反应速率。
(5)保持容器体积不变,向其中充入1 mol N2 , 反应速率。
(6)保持容器内气体压强不变,向其中充入1 mol N2 , 反应速率。
【考点】
化学反应速率的影响因素;
基础巩固
能力提升
变式训练
拓展培优
真题演练