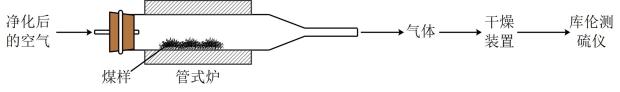
1.
小明选择“铝丝和盐酸反应的快慢与什么因素有关”的课题开展探究。下表是他分别用相同质量的铝丝和足量稀盐酸反应的三组实验数据:
试验编号 | 盐酸的质量分数/% | 反应温度/℃ | 铝丝消失的时间/s |
① | 3 | 20 | 500 |
② | 6 | 20 | 300 |
③ | 6 | 30 | 80 |
(1)
写出铝和稀盐酸反应的化学方程式。
(2)
实验②和③表明:该反应快慢与有关。
(3)
能表明盐酸浓度对反应快慢有影响的实验编号是:和。
(4)
如果把实验①中盐酸的质量分数改为4%,请你推出铝丝消失的时间(用t表示)取值范围。
【考点】
化学反应速率的影响因素;
能力提升
真题演练