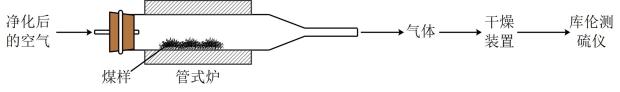
1.
2O2为底物研究化学反应的反应速率及其反应历程。回答下列问题:
(1)
以Fe/Cu/沸石非均相Fenton催化剂,通过与H2O2作用产生强氧化性的·OH自由基和·HO2自由基,能够有效去除水体中污染物,其反应机理如图所示。其中·OH是降解污染物的主要反应活性物质。
(2)
H2O2分解速率受多种因素影响。下图甲、乙、丙、丁是实验测得70℃时不同条件下H2O2浓度随时间的变化情况。

①过程I、Ⅱ的总反应为。
②产生·OH的催化剂是(填离子符号,下同);产生·HO2的催化剂是。
③反应VI的离子方程式为。

①图甲、丁研究了H2O2分解速率的影响因素分别是、(pH除外)。
②图乙研究了溶液的pH对H2O2分解速率的影响,由图可知,其他条件相同时,。
③对比图乙、丙,得出的结论是。
【考点】
化学反应速率的影响因素;
能力提升
真题演练