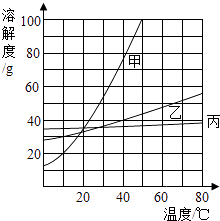
1.
如图所示,一木块漂浮于硝酸钠饱和溶液中,当温度由 升高到
升高到 时
时 不考虑木块和溶液体积的变化
不考虑木块和溶液体积的变化 , 木块排开液体的体积随温度变化如图所示。下列说法错误的是( )
, 木块排开液体的体积随温度变化如图所示。下列说法错误的是( )

A.
硝酸钠的溶解度随温度的升高而增大
B.
 时,该溶液一定是硝酸钠的饱和溶液
C.
升温时,溶液中硝酸钠的溶质质量分数增大
D.
时,该溶液一定是硝酸钠的饱和溶液
C.
升温时,溶液中硝酸钠的溶质质量分数增大
D.
 时,向该溶液加入一定量氯化钠,木块会上浮
时,向该溶液加入一定量氯化钠,木块会上浮
【考点】
饱和溶液和不饱和溶液;
溶解度的影响因素;
固体溶解度曲线及其作用;
基础巩固
能力提升
变式训练
拓展培优
真题演练