酸碱中和反应是初中阶段重要的一类反应,请你参与一起探究。
【实验1】从能量变化角度探究酸和碱的反应
某小组同学测量盐酸与氢氧化钠溶液反应过程中温度的变化,观察到溶液温度升高,因此得出两者能反应的结论。有同学认为此结论不够严谨,在密闭隔热容器中设计了以下实验:
①10mL一定浓度的盐酸与10mL蒸馏水混合,测量溶液温度的变化。
②10mL一定浓度的氢氧化钠溶液与10mL蒸馏水混合,测量溶液温度的变化。
③10mL一定浓度的盐酸与10mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得3个实验中溶液温度随时间变化的关系如图1所示。

(1)从能量角度分析,结合图1说明氢氧化钠和盐酸发生了反应的理由。
(2)从微观角度分析,此中和反应的温度变化主要是由于(填离子符号)两种离子反应放出热量的缘故。
(3)在10mL溶质质量分数为10%的NaOH溶液(密度为1.1g/mL)中加入溶质质量分数为5%的盐酸(密度为1.0g/mL)溶液的体积为mL,就能使反应后溶液的pH等于7.(写出计算过程)
【实验2】从溶液电导率变化角度探究酸和碱的反应
小组同学根据图2进行相应实验操作,利用电导率传感器分别测定A试管和B试管反应过程中溶液的电导率变化,电导率的大小能反映离子浓度的大小。

(4)根据图3所示电导率变化,请写出对应试管中发生反应的化学方程式为。
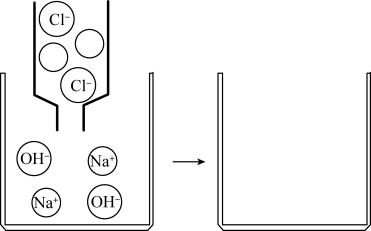
(5)图4中电导率的变化(填“能”或“不能”)说明盐酸和氢氧化钠溶液发生了反应,a点所示溶液中含有的微粒有(填微粒符号)。
【定量再探】
小苏称取4.0g10%的NaOH溶液于烧杯中,再加入一定量的盐酸,搅拌。一段时间后将混合溶液加热蒸干,所得固体至恒重,称量,记其质量为m。
(6)小苏认为盐酸具有挥发性,NaOH溶液与盐酸若不发生反应,则加热蒸干后,所得固体只有NaOH。m的理论取值范围是时,说明NaOH与盐酸发生了化学反应。
(7)小苏同学实验后最终得到固体的质量m为0.41g,有同学认为该数据不能说明NaOH与盐酸发生了化学反应,其理由是。