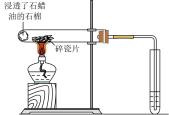
1.
采用空气和 为原料可直接制备
为原料可直接制备 。空气与熔融金属
。空气与熔融金属 反应前需依次通过、(填序号)。
反应前需依次通过、(填序号)。
a.浓硫酸 b.饱和食盐水 c.溶液 d.
溶液
【考点】
性质实验方案的设计;
基础巩固
能力提升
变式训练
拓展培优
真题演练