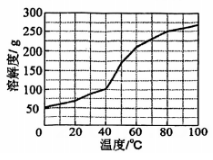
1.
亚硝酰氯( )是一种黄色气体,沸点为
)是一种黄色气体,沸点为 ℃。其液体呈红褐色。遇水发生反应:
℃。其液体呈红褐色。遇水发生反应: 。某化学小组设计如图装置用
。某化学小组设计如图装置用 和
和 制备
制备 。回答下列相关问题:
。回答下列相关问题:

(1)
甲装置发生反应的离子方程式为,装置丙中的液体是浓硫酸。
(2)
实验时,先通入 , 待丁中烧瓶内充满黄绿色气体时,再通入
, 待丁中烧瓶内充满黄绿色气体时,再通入 , 这样做的目的是。
(3)
装置丁中冰盐水的作用是。
(4)
经分析该套装置设计上有一处明显缺陷,改进方法是。(用文字描述)
(5)
吸收尾气时,NOCl发生反应的化学方程式为。(已知:NO+NO2+2NaOH=2NaNO2+H2O)
, 这样做的目的是。
(3)
装置丁中冰盐水的作用是。
(4)
经分析该套装置设计上有一处明显缺陷,改进方法是。(用文字描述)
(5)
吸收尾气时,NOCl发生反应的化学方程式为。(已知:NO+NO2+2NaOH=2NaNO2+H2O)
【考点】
制备实验方案的设计;
能力提升
真题演练




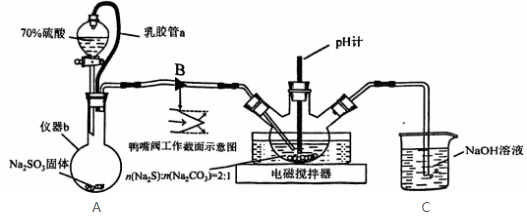
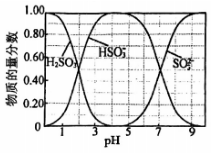 图2
图2