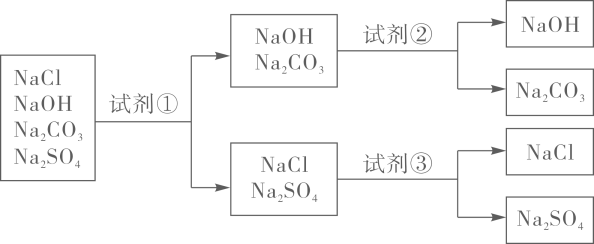
1.
归纳推理是一种重要的科学思维方法,下列归纳推理正确的( )
A.
酸都能在溶液中解离出H+ , 则含氢元素的化合物都是酸
B.
酸具有相似的化学性质,硫酸能与氯化钡反应,所以硝酸也可以与氯化钡反应
C.
常温下,碱溶液的pH大于7,则pH大于7的溶液一定是碱溶液
D.
碱能与某些非金属氧化物反应,所以KOH溶液可以跟CO2发生反应
【考点】
酸的化学性质;
碱的化学性质;