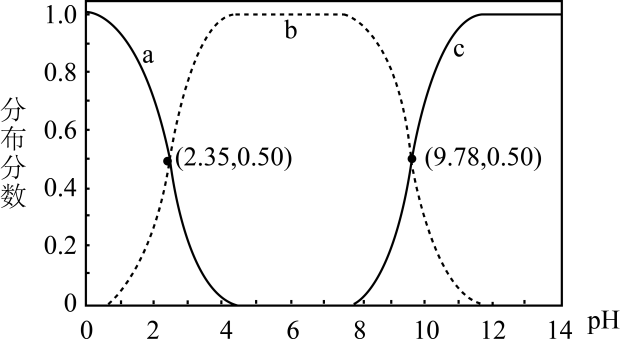
1.
电离常数是研究电解质在水溶液中行为的重要工具。现有HX、 和
和 三种酸,各酸及其盐之间不发生氧化还原反应,它们的电离常数如表所示。
三种酸,各酸及其盐之间不发生氧化还原反应,它们的电离常数如表所示。
酸 | 电离常数(25℃) |
HX | |
| |
|
下列说法正确的是
A.
 溶液中离子浓度的关系:
溶液中离子浓度的关系: B.
B.
 溶液与过量HX反应的离子方程式:
溶液与过量HX反应的离子方程式: C.
相同物质的量浓度的
C.
相同物质的量浓度的 , 溶液
, 溶液 的关系:
的关系: D.
25℃时,浓度均为
D.
25℃时,浓度均为 的
的 和
和 溶液的
溶液的
【考点】
电离平衡常数;
基础巩固
能力提升
变式训练
拓展培优
真题演练