1.
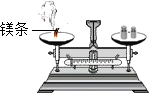
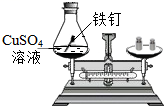
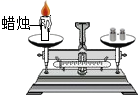
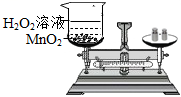
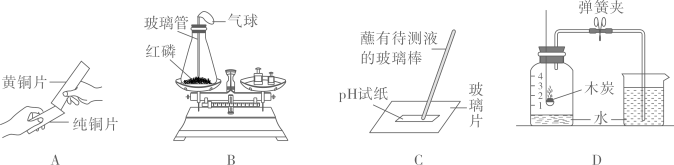
下列装置及实验(天平未画出)能用来验证质量守恒定律的是
A.
镁条燃烧 B.
红磷燃烧
B.
红磷燃烧 C.
水和油混合
C.
水和油混合 D.
制取氧气
D.
制取氧气
 B.
红磷燃烧
B.
红磷燃烧 C.
水和油混合
C.
水和油混合 D.
制取氧气
D.
制取氧气【考点】
验证质量守恒定律;
基础巩固
能力提升
变式训练
拓展培优
真题演练
























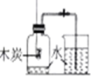 测定空气中氧气的含量
测定空气中氧气的含量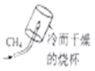 探究甲烷中是否含碳元素
探究甲烷中是否含碳元素 验证质量守恒定律
验证质量守恒定律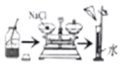 配制一定溶质质量分数的氯化钠溶液
配制一定溶质质量分数的氯化钠溶液