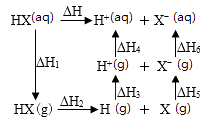1.
奥运会火炬常用的燃料为丙烷和甲醇。丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:
相同条件下,反应的
。
【考点】
盖斯定律及其应用;
基础巩固
能力提升
变式训练
拓展培优
真题演练