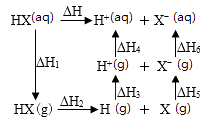1.
已知下列热化学方程式:
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g) △H1=-25kJ•mol-1;
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g) △H2=-47kJ•mol-1;
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g) △H3=+19kJ•mol-1 .
写出FeO(s)被CO还原成Fe和CO2的热化学方程式。
【考点】
盖斯定律及其应用;
基础巩固
能力提升
变式训练
拓展培优
真题演练