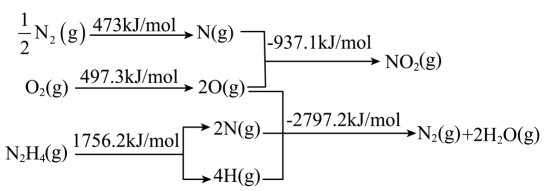
1.
氢卤酸的能量关系如图所示:下列说法正确的是( )
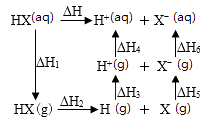
A.
已知HF气体溶于水放热,则HF的ΔH1<0
B.
相同条件下,HCl的ΔH2比HBr的小
C.
相同条件下,HCl的(ΔH3+ΔH4)比HI的大
D.
一定条件下,气态原子生成1 mol H-X键放出a kJ能量,则该条件下ΔH2=a kJ·molˉ1
【考点】
盖斯定律及其应用;
反应热的大小比较;
基础巩固
能力提升
变式训练
拓展培优