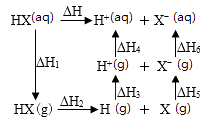1.
向 溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是
溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是

A.
反应 (1)为放热反应
B.
(1)为放热反应
B.
 C.
C.
 D.
D.
 (1),若使用催化剂,则
(1),若使用催化剂,则 变小
变小
【考点】
盖斯定律及其应用;

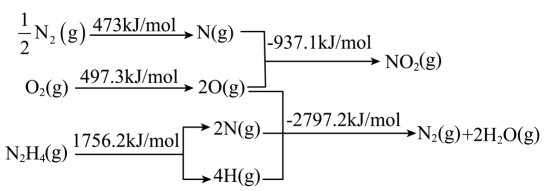





 B.
B.
 D.
D.