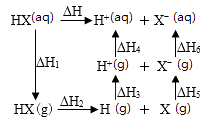1.
根据下图和热反应方程式,写反应II的热化学方程。

反应I:2H2SO4(l)=2SO2(g) + O2 (g) + 2H2O(g) ΔH1 = 551 kJ/mol
反应III:S(s) + O2 (g)=SO2 (g) ΔH3 =−297 kJ/mol
【考点】
盖斯定律及其应用;
基础巩固
能力提升
变式训练
拓展培优
真题演练