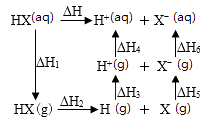1.
热力学标准状况(298.15K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热(∆H)。图甲为ⅥA族元素氢化物a、b、c、d的生成热数据示意图。试完成下列问题。

(1)①请你归纳非金属元素氢化物的稳定性与氢化物的生成热∆H的关系:。
②硒化氢在上述条件下发生分解反应的热化学方程式为。(已知该条件下除硒是固体,其余都是气体。)
(2)在25℃、101kPa下,已知SiH4气体在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热190kJ,该反应的热化学方程式是。
(3)根据图乙写出反应的热化学方程式:。
(4)由金红石()制取单质Ti的步骤为:
Ti
已知:I.
II.
III.
①的∆H=。
②反应在Ar气氛中进行的理由是。
【考点】
盖斯定律及其应用;