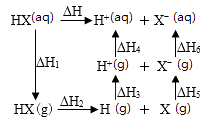1.
已知:血红蛋白可与 结合,血红蛋白更易与CO配位,血红蛋白与
结合,血红蛋白更易与CO配位,血红蛋白与 配位示意如图所示,血红蛋白(Hb)与
配位示意如图所示,血红蛋白(Hb)与 、CO结合的反应可表示为①
、CO结合的反应可表示为①
 ;②
;②
 下列说法错误的是
下列说法错误的是

A.
已知反应
 , 则
, 则 B.
相同温度下,
B.
相同温度下, C.
血红蛋白结合
C.
血红蛋白结合 后Fe的配位数为6
D.
高压氧舱可治疗CO中毒
后Fe的配位数为6
D.
高压氧舱可治疗CO中毒
【考点】
盖斯定律及其应用;