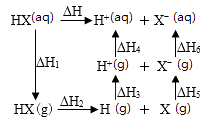1.
Ⅰ.设为分压平衡常数(用分压代替浓度,气体分压
总压
该组分的物质的量分数),50℃、101kPa下,将足量的
、
置于一个密闭容器中,再充入已除去
的干燥空气。假设只发生如下反应,已知达平衡时两者分解的物质的量比为
。
(1)①平衡时,
。
②平衡后,用总压为101kPa的潮湿空气[其中、
]替换容器中的气体,50℃下达到新平衡。容器内,
质量将(填“增加”“减少”或“不变”)。
Ⅱ.反应中产生的可以以Bi为电极,在酸性水溶液中实现电催化还原,两种途径的反应机理如图1所示,其中TS表示过渡态、数字表示微粒的相对总能量。

(2)电还原的选择性以途径一为主,理由是。
Ⅲ.还可以通过催化加氢制甲醇,其总反应可表示为:
。向另一恒容密闭容器中按
和
物质的量的比为
投料,在有催化剂的密闭容器中进行以下反应:
主反应:
副反应:
测得平衡转化率、和CO选择性[转化的
中生成或CO的百分比,如:选择性
]随温度、压强变化情况分别如图2、图3所示:

(3)①图2中,240℃以上,随着温度升高,的平衡转化率增大,而
的选择性降低。分析其原因:。
②图3中,温度时,三条曲线几乎交于一点,分析其原因:。
(4)合成的甲醇可利用和CuO纳米片(CuONS/CF)作催化电极,进一步制备甲酸(甲酸盐),其电化学装置的工作原理如下图所示。

①电解过程中阴极上发生反应的电极反应式为。
②若有1mol通过质子交换膜时,则该装置生成
和HCOOH共计mol。
【考点】
盖斯定律及其应用;