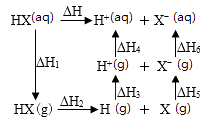1.
探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。
Ⅰ.以CO2、H2为原料合成CH3OH涉及的主要反应如下:
反应①:
。
反应②:
。
反应③:
。
不同压强下,按照投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。

(1) ________
。
(2)其中纵坐标表示CO2平衡转化率的是图________(填“甲”或“乙”)。
(3)图乙中T1温度时,三条曲线几乎交于一点的原因是________。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_______(填标号)。
| A. 低温、高压 | B. 高温、低压 | C. 低温、低压 | D. 高温、高压 |
(5)我国学者提出“反应①”的反应机理(其中吸附在催化剂表面的物种用“*”标注)如下图所示,其中过程b中含碳物种被________(填“氧化”或“还原”)。

Ⅱ.以乙烯气相水合反应生成C2H5OH涉及的主要反应如下:
反应④:
,
(6)下图是乙烯的平衡转化率与温度、压强的关系[其中]。

①图中压强(p1、p2、p3、p4)由大到小的顺序为________。
②若p1=8.0 MPa,计算A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算;分压=总压×物质的量分数;结果保留两位有效数字)。
【考点】
盖斯定律及其应用;
能力提升
变式训练
拓展培优
真题演练