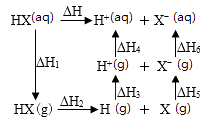1.
采用热分解法脱除沼气中的 过程中涉及的主要反应为
过程中涉及的主要反应为
反应Ⅰ:
kJ⋅mol
反应Ⅱ:
kJmol
保持100kPa不变,将与
按2∶1体积比投料,并用
稀释,在不同温度下反应达到平衡时,所得
、
与
的体积分数如题13图所示。下列说法正确的是

题13图
A.
反应 的
的 kJ⋅mol
kJ⋅mol B.
曲线Y代表的是
B.
曲线Y代表的是 的平衡体积分数
C.
高于1050℃时,
的平衡体积分数
C.
高于1050℃时, 平衡转化率与
平衡转化率与 平衡转化率的差值随温度升高减小
D.
1050℃下反应,增大体系的压强,平衡后H2的体积分数可能达到0.07
平衡转化率的差值随温度升高减小
D.
1050℃下反应,增大体系的压强,平衡后H2的体积分数可能达到0.07
【考点】
盖斯定律及其应用;