1.
某实验室利用 和
和 反应合成硫酰氯
反应合成硫酰氯 , 并对
, 并对 和
和 的酸性强弱进行探究。已知:①
的酸性强弱进行探究。已知:① 的熔点为
的熔点为 , 沸点为
, 沸点为 , 在空气中遇水蒸气发生剧烈反应,并产生大量
, 在空气中遇水蒸气发生剧烈反应,并产生大量 白雾,
白雾, 以上分解生成
以上分解生成 和
和 ;②实验室合成
;②实验室合成 的原理:
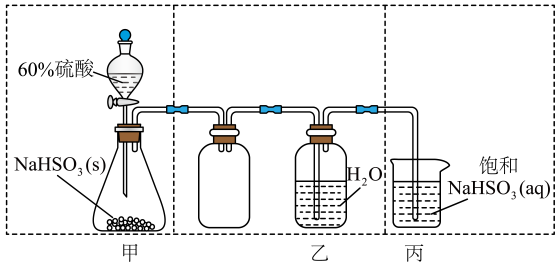
的原理: , 且反应会放出大量的热。实验装置如图(夹持仪器已省略)请回答下列问题:
, 且反应会放出大量的热。实验装置如图(夹持仪器已省略)请回答下列问题:

(1)
装置中碱石灰所起的作用、。
(2)
装置戊上方分液漏斗中最好选用___________(填字母)。
A.
蒸馏水
B.
浓氢氧化钠溶液
C.
饱和食盐水
D.
 盐酸
(3)
装置乙和丁盛放的试剂均是。
(4)
盐酸
(3)
装置乙和丁盛放的试剂均是。
(4)
 和水反应的化学方程式为。
(5)
装置丙放置在冰水浴中的原因是。
(6)
选用下面的装置探究酸性:
和水反应的化学方程式为。
(5)
装置丙放置在冰水浴中的原因是。
(6)
选用下面的装置探究酸性: , 溶液均足量。
, 溶液均足量。

其连接顺序正确的为:(填序号)
①ACF
②ACBF
③ACBEDF
④ABCEDF
能证明的酸性强于
的实验现象为。
【考点】
制备实验方案的设计;
能力提升
真题演练