1.
实验室利用下列装置模拟工业生产制备少量硝酸。

(1)
实验室制备 和
和 可以采用相同的装置。
(2)
实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到
可以采用相同的装置。
(2)
实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到 以上。下列图示中,能够正确表示该反应过程能量变化的是。(已知:g−气态;l−液态)
(3)
A瓶除了让气体混合均匀以外,还可以起到的作用。
(4)
B瓶中反应的化学方程式为。
(5)
实验结束时,两种反应气体中需要再持续通入(填化学式)一段时间。
(6)
控制氨气和氧气的比例是制备硝酸的关键。
以上。下列图示中,能够正确表示该反应过程能量变化的是。(已知:g−气态;l−液态)
(3)
A瓶除了让气体混合均匀以外,还可以起到的作用。
(4)
B瓶中反应的化学方程式为。
(5)
实验结束时,两种反应气体中需要再持续通入(填化学式)一段时间。
(6)
控制氨气和氧气的比例是制备硝酸的关键。

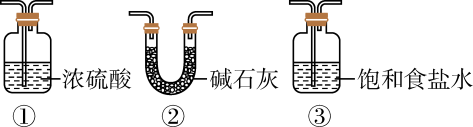
①如果都用甲装置进行常规制备,则制可向试管中放
;制
时试管内应盛放
和(写化学式)。
②如果都用乙装置快速制取气体,则制时分液漏斗盛浓氨水,圆底烧瓶盛放生石灰;制
时分液漏斗内盛蒸馏水,则圆底烧瓶内发生反应的化学方程式为。
a. b.
b.
c. d.
d.
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。白烟是(填化学式)。
②理论上若要让氨气完全转化为硝酸,则至少要同时通入
的
。
【考点】
制备实验方案的设计;
能力提升
真题演练