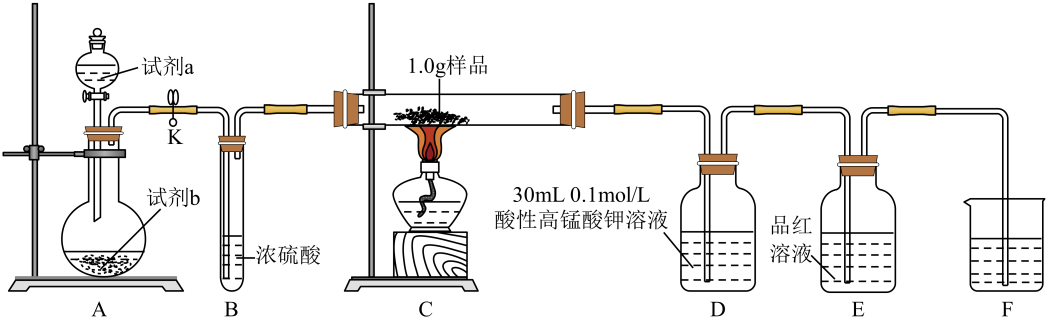
1.
 作为绿色氧化剂应用广泛,氢醌法制备
作为绿色氧化剂应用广泛,氢醌法制备 原理及装置如下:
原理及装置如下:

已知:、
等杂质易使
催化剂中毒。回答下列问题:
(1)
A中反应的离子方程式为。
(2)
装置B应为(填序号)。
(3)
检查装置气密性并加入药品,所有活塞处于关闭状态。开始制备时,打开活塞,控温 。一段时间后,仅保持活塞b打开,抽出残留气体。随后关闭活塞b,打开活塞,继续反应一段时间。关闭电源和活塞,过滤三颈烧瓶中混合物,加水萃取,分液,减压蒸馏,得产品。
(4)
装置F的作用为。
(5)
反应过程中,控温
。一段时间后,仅保持活塞b打开,抽出残留气体。随后关闭活塞b,打开活塞,继续反应一段时间。关闭电源和活塞,过滤三颈烧瓶中混合物,加水萃取,分液,减压蒸馏,得产品。
(4)
装置F的作用为。
(5)
反应过程中,控温 的原因为。
(6)
氢醌法制备
的原因为。
(6)
氢醌法制备 总反应的化学方程式为。
(7)
取
总反应的化学方程式为。
(7)
取 产品,加蒸馏水定容至
产品,加蒸馏水定容至 摇匀,取
摇匀,取 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、 、
、 。假设其他杂质不干扰结果,产品中
。假设其他杂质不干扰结果,产品中 质量分数为。
质量分数为。

【考点】
中和滴定;
探究物质的组成或测量物质的含量;
制备实验方案的设计;
能力提升