1.
为探究某铁硫簇化合物(用FexSy表示)的组成,某化学兴趣小组设计了如图所示的实验装置测定样品中铁、硫的含量:
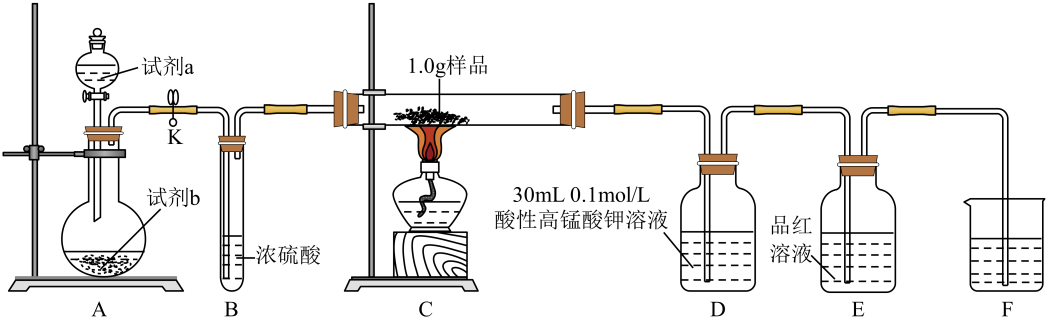
已知: i.样品的主要成分为FexSy , 含少量不溶于水、盐酸,且不参与装置C中反应的杂质;
ii. Mn2+在稀溶液中近乎无色。
实验步骤:
①按图连接装置,进行气密性检查,然后装入相应的药品;
②通入氧气并加热,装置C中固体逐渐转变为红棕色;
③待固体完全转化后,取装置D中的溶液6 mL于锥形瓶中,用0.1 mol·L-1的H2C2O4(草酸)溶液滴定。滴定共进行3次,平均消耗草酸溶液5.0 mL(假设装置D中溶液体积反应前后不变);
④取装置C中的残留固体于烧杯中,加入稀盐酸,充分搅拌后过滤;
⑤向滤液中加入足量氢氧化钠溶液,出现沉淀。过滤后取滤渣灼烧,得0.32 g固体。
回答下列问题:
(1)
A为O2发生装置,则试剂a、试剂b可以分别是。
(2)
装置E中品红溶液的作用是。
(3)
写出草酸溶液滴定酸性高锰酸钾溶液时反应的离子方程式:。( → Mn2+)。
(4)
为防止尾气污染,装置F中应加入的试剂是, 步骤⑤中灼烧滤渣应在进行(填仪器名称)。
(5)
若实验完成时装置E中品红溶液无变化,根据上述实验所得数据,可确定该铁硫簇化合物的化学式为,写出该铁硫簇化合物与O2反应的化学方程式:。
(6)
下列操作,可能导致x:y的值偏小的是(填字母)。
→ Mn2+)。
(4)
为防止尾气污染,装置F中应加入的试剂是, 步骤⑤中灼烧滤渣应在进行(填仪器名称)。
(5)
若实验完成时装置E中品红溶液无变化,根据上述实验所得数据,可确定该铁硫簇化合物的化学式为,写出该铁硫簇化合物与O2反应的化学方程式:。
(6)
下列操作,可能导致x:y的值偏小的是(填字母)。
a.步骤⑤灼烧滤渣不够充分
b.配制草酸标准液时,定容操作俯视刻度线
c.滴定时,草酸溶液不小心滴到锥形瓶外几滴
d.放出草酸的滴定管尖嘴部分滴定前无气泡,滴定终点时有气泡
【考点】
探究物质的组成或测量物质的含量;
能力提升
真题演练



 )对胃黏膜刺激较小,是一种治疗缺铁性贫血的安全有效的铁制剂。某实验小组制备富马酸亚铁并测定产品中铁的质量分数。
)对胃黏膜刺激较小,是一种治疗缺铁性贫血的安全有效的铁制剂。某实验小组制备富马酸亚铁并测定产品中铁的质量分数。




