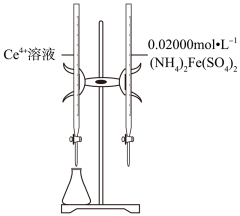
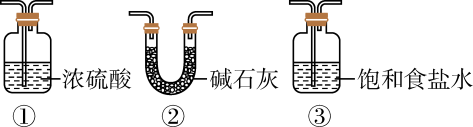
1.
铁是人体必需的微量元素之一。黑木耳中的含铁量较高,为检验和测定干黑木耳样品中的铁元素,设计实验如下。回答下列问题:
(1)
I.铁元素的检验
(2)
取待测液少许,滴加K3[Fe(CN)6]溶液,观察到有蓝色沉淀生成;另取待测液少许,滴加(填化学式)溶液,观察到溶液变为红色,由此可得出结论(填字母序号)。
(3)
II.铁元素含量的测定
![]()
“操作”是指;上述流程中需要用到的仪器有托盘天平、烧杯、玻璃棒、酒精灯、漏斗,还有下图中的(填写仪器名称)。

a.黑木耳中一定含Fe2+和Fe3+
b.待测液中一定含Fe2+和Fe3+
利用KMnO4标准溶液测定干黑木耳样品中铁元素的含量
步骤I:取10.00mL待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
步骤II:向步骤I所得的溶液中加入适量稀H2SO4溶液,用0.0020mol·L-1的KMnO4标准溶液滴定至终点,消耗KMnO4溶液2.20mL。
①步骤I加入过量铜粉的目的是。
②步骤II滴加KMnO4溶液时发生反应的离子方程式为。
③用KMnO4标准溶液滴定至终点的标志是。。
④黑木耳中铁的含量为mg/100g(即每100g黑木耳中含铁元素的质量)。
【考点】
探究物质的组成或测量物质的含量;
能力提升
真题演练
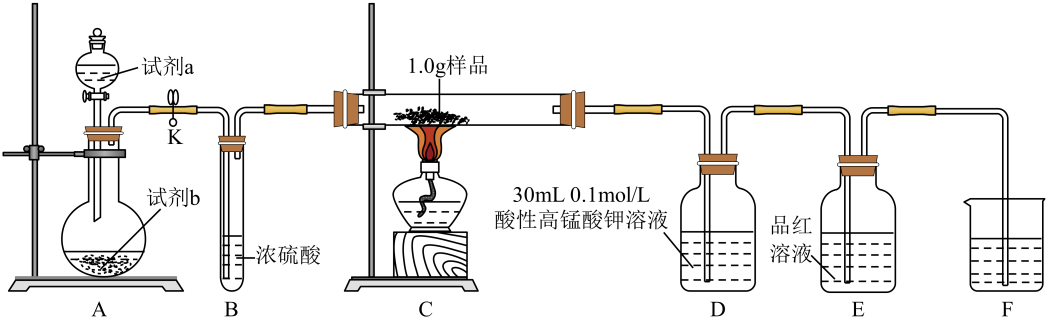


 )对胃黏膜刺激较小,是一种治疗缺铁性贫血的安全有效的铁制剂。某实验小组制备富马酸亚铁并测定产品中铁的质量分数。
)对胃黏膜刺激较小,是一种治疗缺铁性贫血的安全有效的铁制剂。某实验小组制备富马酸亚铁并测定产品中铁的质量分数。