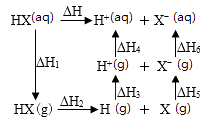1.
已知:
下列说法正确的是
A.
∆H1<0,∆H2<0,∆H3<∆H4
B.
6∆H1+∆H2+∆H3-∆H4=0
C.
-6∆H1+∆H2+∆H3-∆H4=0
D.
-6∆H1+∆H2-∆H3+∆H4=0
【考点】
反应热的大小比较;