1.
向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图一所示。

(1)烧杯中的溶液一定属于饱和溶液的是(填序号);
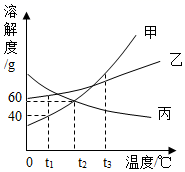
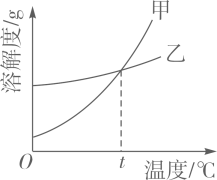
(2)图二能表示NaNO3溶解度曲线的是(填“甲”或“乙”);
(3)由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的(填序号)。
A.甲、乙都是饱和溶液
B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙
D.溶质质量分数:甲>乙
【考点】
饱和溶液和不饱和溶液;
溶解度的影响因素;
固体溶解度曲线及其作用;
基础巩固
能力提升
变式训练
拓展培优
真题演练