1.
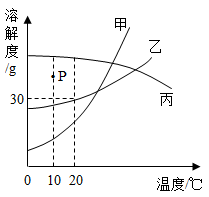
A、B、C三种不含结晶水的固体物质的溶解度曲线如图,回答下列问题:

(1)t1℃时,A的饱和溶液65 g中含有溶剂 g。
(2)将t2℃A、B、C三种物质的饱和溶液降温至t1℃时,溶质的质量分数保持不变的是溶液。
(3)A物质中混有B物质,提纯A物质用方法。
(4)在不改变溶液质量的前提下,将C的不饱和溶液变成饱和溶液采用的方法是。
【考点】
固体溶解度曲线及其作用;
能力提升
变式训练
拓展培优
真题演练