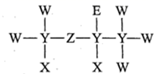1.
根据元素周期律,由下列事实进行归纳推测,推测不合理的是
事实 | 推测 | |
A | 12Mg与水反应缓慢,20Ca与水反应较快 | 56Ba(ⅡA族)与水反应会更快 |
B | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
D | Si是半导体材料,同族的Ge也是半导体材料 | ⅣA族的元素单质都是半导体材料 |
A.
A
B.
B
C.
C
D.
D
【考点】
元素周期表中原子结构与元素性质的递变规律;
元素周期律和元素周期表的综合应用;
基础巩固
能力提升
变式训练
拓展培优
真题演练