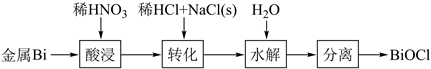
1.
连二亚硫酸钠 俗称保险粉,是印染工业中常用的漂白剂。实验室制备流程如下:
俗称保险粉,是印染工业中常用的漂白剂。实验室制备流程如下:

下列说法错误的是
A.
将锌粉溶于水形成悬浊液可以提高反应速率
B.
生成 的反应中氧化剂和还原剂物质的量之比为
的反应中氧化剂和还原剂物质的量之比为 C.
温度超过
C.
温度超过 会导致
会导致 溶解度降低
D.
加入
溶解度降低
D.
加入 有利于
有利于 析出,提高产率
析出,提高产率
【考点】
物质的分离与提纯;
制备实验方案的设计;