1.
二苯乙醇酸是一种皮肤再生调节剂。由二苯乙二酮制备二苯乙醇酸的反应原理为:

实验步骤如下:
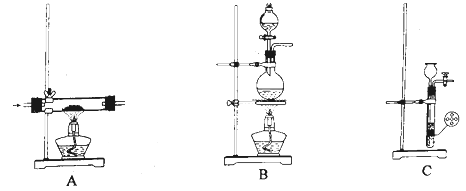
Ⅰ.在圆底烧瓶中加入水、
二苯乙二酮和
95%乙醇溶液、水浴加热回流
(装置如图,加热及夹持装置省略)。

Ⅱ.将Ⅰ中所得混合物转入烧杯中,冰水浴冷却结晶,过滤、洗涤。将晶体溶于蒸馏水中,调节
至少量胶状物(未反应的二苯乙二酮)浮于液面,加入活性炭,搅拌、过滤。
Ⅲ.向滤液中缓慢滴加5.0%盐酸,调节(用刚果红试纸检测)。冰水浴冷却,有大量晶体析出。过滤、冰水洗涤,得粗产品。
Ⅳ.将粗产品加热水溶解,冷却结晶,过滤、冰水洗涤、干燥,得产品。
已知:①相关物质的信息见下表
物质 | 性质 | 熔点/℃ | 溶解性 | ||
二苯乙二酮 | 210 | 淡黄色固体 | 95 | — | 不溶于水,溶于乙醇、苯 |
二苯乙醇酸 | 228 | 无色晶体 | 150 | 3.06 | 易溶于热水或苯,难溶于冰水 |
②刚果红试纸变色范围:![]()
回答下列问题:
(1)
步骤Ⅰ中选用量筒的最适宜规格为(填标号)。
(2)
圆底烧瓶中加沸石的作用是。
(3)
步骤Ⅱ加活性炭的目的是。
(4)
步骤Ⅲ中刚果红试纸变色时,停止滴加盐酸;溶液中涉及的化学方程式为。
(5)
步骤Ⅳ中检验产品是否洗净的方法为。
(6)
关于该实验,下列说法错误的是(填标号)。
(7)
二苯乙醇酸的产率为(列出计算式即可)。
(8)
不改变装置和原料用量,提高产率的方法有(填一条即可)。
A. B.
C.
A.步骤Ⅰ改用酒精灯直接加热更便于控制体系温度
B.步骤Ⅳ的操作为重结晶
C.可通过测定二苯乙醇酸的熔点定性判断其纯度
【考点】
物质的分离与提纯;
制备实验方案的设计;
能力提升
真题演练



 )得到。某化学兴趣小组利用化学解聚方法,先由废旧聚乳酸餐盒制得乳酸,再与碳酸亚铁反应可得乳酸亚铁晶体。已知:
)得到。某化学兴趣小组利用化学解聚方法,先由废旧聚乳酸餐盒制得乳酸,再与碳酸亚铁反应可得乳酸亚铁晶体。已知: