1.
硫化钠可广泛用于染料、医药行业。工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。回答下列问题:
(1)
工业上常用芒硝( )和煤粉在高温下生产硫化钠,同时生成CO,该反应的化学方程式为。
(2)
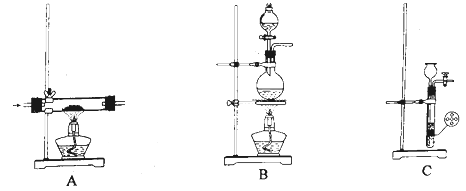
溶解回流装置如图所示,回流前无需加入沸石,其原因是。回流时,烧瓶内气雾上升高度不宜超过冷凝管高度的1/3.若气雾上升过高,可采取的措施是。
(3)
回流时间不宜过长,原因是。回流结束后,需进行的操作有①停止加热 ②关闭冷凝水 ③移去水浴,正确的顺序为(填标号)。
(4)
该实验热过滤操作时,用锥形瓶而不能用烧杯接收滤液,其原因是。过滤除去的杂质为。若滤纸上析出大量晶体,则可能的原因是。
(5)
滤液冷却、结晶、过滤,晶体用少量洗涤,干燥,得到
)和煤粉在高温下生产硫化钠,同时生成CO,该反应的化学方程式为。
(2)
溶解回流装置如图所示,回流前无需加入沸石,其原因是。回流时,烧瓶内气雾上升高度不宜超过冷凝管高度的1/3.若气雾上升过高,可采取的措施是。
(3)
回流时间不宜过长,原因是。回流结束后,需进行的操作有①停止加热 ②关闭冷凝水 ③移去水浴,正确的顺序为(填标号)。
(4)
该实验热过滤操作时,用锥形瓶而不能用烧杯接收滤液,其原因是。过滤除去的杂质为。若滤纸上析出大量晶体,则可能的原因是。
(5)
滤液冷却、结晶、过滤,晶体用少量洗涤,干燥,得到 。
。

A.①②③ B.③①② C.②①③ D.①③②
【考点】
物质的分离与提纯;
制备实验方案的设计;
能力提升
真题演练