1.
下列图像能正确反映对应变化关系的是( )
|
|
|
|
A.20℃时,向一定量的硝酸钾不饱和溶液中加入硝酸钾固体 | B.将等质量的镁片和铁片投入到足量稀硫酸中 | C.用酒精灯加热一定量的高锰酸钾固体 | D.向盛有少量二氧化锰的烧杯中不断地加入过氧化氢溶液 |
A.
A
B.
B
C.
C
D.
D
【考点】
氧气的实验室制法;
金属的化学性质;
基础巩固
能力提升
变式训练
拓展培优
真题演练









 图①表示等质量等浓度的过氧化氢溶液分别在有、无MnO2的条件下反应
图①表示等质量等浓度的过氧化氢溶液分别在有、无MnO2的条件下反应 图②表示等质量的块状碳酸钙与碳酸钙粉末分别与足量等浓度的稀盐酸反应
图②表示等质量的块状碳酸钙与碳酸钙粉末分别与足量等浓度的稀盐酸反应 图③表示等质量的锌粉和铁粉分别与足量的等浓度的稀盐酸反应
图③表示等质量的锌粉和铁粉分别与足量的等浓度的稀盐酸反应 图④表示足量的锌粉和铁粉分别与等质量等浓度的稀盐酸反应
图④表示足量的锌粉和铁粉分别与等质量等浓度的稀盐酸反应 向两份等质量、相同质量分数的稀硫酸中,分别不断加入镁粉和锌粉
向两份等质量、相同质量分数的稀硫酸中,分别不断加入镁粉和锌粉 向一定量的氯化锌和氯化铜混合溶液中加入镁粉
向一定量的氯化锌和氯化铜混合溶液中加入镁粉 等质量的镁、铁分别与溶质质量分数相等且足量的稀硫酸反应
等质量的镁、铁分别与溶质质量分数相等且足量的稀硫酸反应 加热一定量氯酸钾和二氧化锰固体的混合物
加热一定量氯酸钾和二氧化锰固体的混合物








 在密闭的容器中加热汞得到氧化汞
在密闭的容器中加热汞得到氧化汞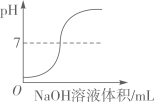 向一定量的稀盐酸中滴加氢氧化钠溶液
向一定量的稀盐酸中滴加氢氧化钠溶液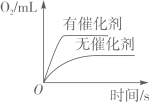 两份等质量、等溶质的质量分数的过氧化氢溶液分别制取氧气
两份等质量、等溶质的质量分数的过氧化氢溶液分别制取氧气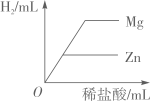 向等质量的Zn和Mg中分别滴加等溶质质量分数的稀盐酸
向等质量的Zn和Mg中分别滴加等溶质质量分数的稀盐酸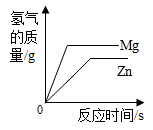 向两份等质量,相同质量分数的稀硫酸中,分别不断加入镁粉和锌粉
向两份等质量,相同质量分数的稀硫酸中,分别不断加入镁粉和锌粉 向一定质量二氧化锰固体中加入一定质量的过氧化氢溶液
向一定质量二氧化锰固体中加入一定质量的过氧化氢溶液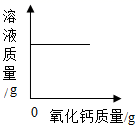 温度不变,向一定质量饱和氢氧化钙溶液中加入氧化钙
温度不变,向一定质量饱和氢氧化钙溶液中加入氧化钙 向一定质量硫酸和硫酸铜的混合溶液中加入氢氧化钠溶液。
向一定质量硫酸和硫酸铜的混合溶液中加入氢氧化钠溶液。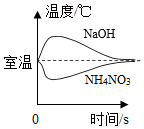 把NaOH和NH4NO3固体分别溶于水中
把NaOH和NH4NO3固体分别溶于水中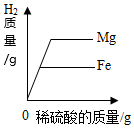 分别向等质量镁和铁中,逐渐加入溶质质量分数相同的稀硫酸至过量
分别向等质量镁和铁中,逐渐加入溶质质量分数相同的稀硫酸至过量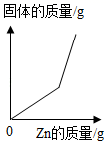 向一定质量硝酸银的混合溶液中逐渐加入锌粉
向一定质量硝酸银的混合溶液中逐渐加入锌粉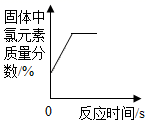 加热一定质量氯酸钾和二氧化锰的固体混合物
加热一定质量氯酸钾和二氧化锰的固体混合物