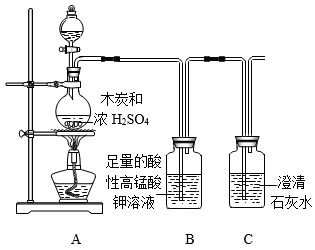
1.
某碳酸钠样品中可能含硫酸钠、氯化钡、碳酸钙中的一种或几种杂质,对碳酸钠样品中杂质的成分进行如下探究:

由上述流程和相关现象可知,该样品的杂质中一定含有氯化钡和硫酸钠。
操作
是 ,现象
是 。
写出生成白色沉淀的一个化学方程式 。
溶液
中一定含有的溶质是 。
另取
该碳酸钠样品加入
稀盐酸,恰好完全反应,生成
二氧化碳。根据数据能否确定样品中含有碳酸钙,请分析说明 。
【考点】
实验探究物质的组成成分以及含量;
能力提升
变式训练
拓展培优
真题演练