1.
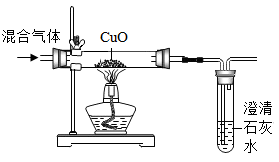
按如图所示装置,持续通入气态物质X(X是H2、CO、H2O中的一种、两种或三种;无水CuSO4遇水变蓝色)。下列有关说法正确的是( )

A.
若玻璃管中固体变成红色,说明X一定是CO
B.
若无水CuSO4变蓝色,说明X中一定含有氢元素
C.
若石灰水变浑浊,则尾气可以用氢氧化钠溶液吸收
D.
若固体变红色,无水CuSO4变蓝且石灰水浑浊,则X一定是三种气体的混合物
【考点】
实验探究物质的组成成分以及含量;
基础巩固
能力提升
变式训练
拓展培优
真题演练