1.
侯德榜是我国制碱工业的先驱,为纯碱和氮肥工业的发展作出了杰出贡献。工业纯碱中可能混有少量NaCl,同学们对工业纯碱样品展开探究。
(1)
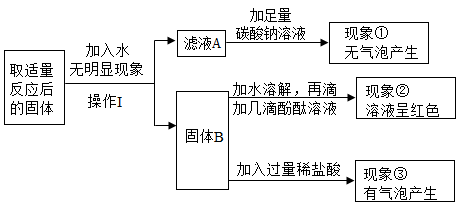
探究一:确定纯碱样品中是否含有NaCl
(2)
探究二:测定纯碱样品中Na2CO3的质量分数
(3)
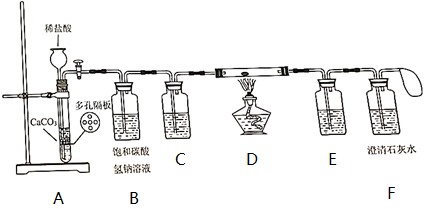
【方案2】如1图所示,取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据干燥管增重计算Na2CO3的质量分数。若结果大于100%,可能的原因是。
(4)
【拓展】2图为Na2CO3和NaCl的溶解度曲线。为提纯含少量NaCl的纯碱样品,将其浓溶液从t1℃冷却至t2℃,t1一t2的最优范围是(填字母)。
实验操作 | 现象 | 结论 |
取样品加水溶解,加入过量稀盐酸至反应完全 | 有产生 | 样品中有NaCl |
向上述溶液中继续滴加适量AgNO3溶液 | 有产生 |
有同学认为该实验方案有不正确,正确方案应选用(填字母)代替稀盐酸。
a.CaCl2溶液 b.稀硝酸 c.BaCl2溶液
【方案1】将样品溶解,加入过量CaCl2溶液,搅拌至反应完全。该反应的化学方程式为。过滤、洗涤、干燥,称量沉淀的质量,计算Na2CO3的质量分数。
【讨论】上述两个方案中,你认为方案更优。

a.40-10 b.60-30 c.70-40
【考点】
实验探究物质的组成成分以及含量;
化学实验方案设计与评价;
能力提升
真题演练