1.
钠是一种很活泼的金属,加热条件下可以在二氧化碳气体中燃烧。某化学实验小组在老师的指导下设计如下实验,探究钠在二氧化碳中的燃烧,并对反应后的固体产物成分进行分析。
【查阅资料】
①Na是一种银白色金属,化学性质很活泼,常温下可与O2、H2O等物质发生反应,加热条件下与O2反应生成较复杂的氧化物。
②Na2O为白色固体,溶于水并与H2O反应生成NaOH,还能与CO2反应生成Na2CO3。
【实验过程】
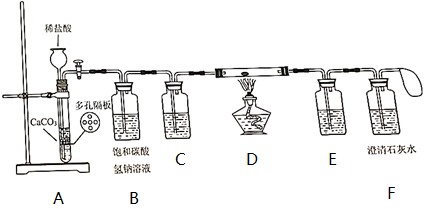
③打开活塞,向长颈漏斗中加入适量盐酸,让产生的气体依次通过后面装置。
④待F中石灰水变浑浊,点燃酒精灯加热,金属钠熔化并开始燃烧,熄灭酒精灯,待钠燃烧完全且试管冷却后再关闭活塞,观察产物为白色固体。
(1)
【反思评价】
(2)
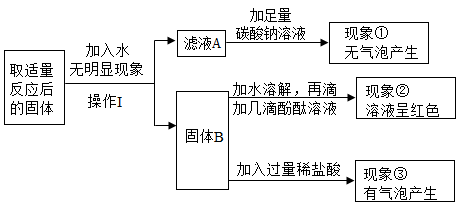
【提出问题】燃烧产物中白色固体物质的主要成分是什么?
(3)
【反思拓展】
①实验过程中为什么要先通一会CO2再点燃酒精灯而不是直接点燃酒精灯?。
②C和E装置中盛放的试剂都是(填试剂名称);B装置的作用是。
【进行猜想】
猜想一:只有Na2O;猜想二:只有Na2CO3;猜想三:既有Na2O又有Na2CO3
【实验探究】为验证猜想,小组同学设计如下实验,请填写表格中空白处。
实验 | 实验操作 | 实验现象 | 实验结论 |
Ⅰ | 将固体样品溶于水,取溶液少许于试管中,向其中滴加过量盐酸,观察现象。 | 猜想一不正确 | |
Ⅱ | 再取样品溶液少许于试管中,先向其中滴加过量BaCl2溶液(BaCl2溶液呈中性),待沉淀完全后静置,再取上层清液少许于试管中,滴入几滴无色酚酞溶液,观察现象。 | 溶液变红 | 猜想正确 |
小组有同学提出将实验Ⅱ中的无色酚酞溶液改成MgCl2溶液也可验证相同的猜想,请写出相应的实验现象:。
【考点】
实验探究物质的组成成分以及含量;
化学实验方案设计与评价;
能力提升
真题演练