基础巩固
能力提升
变式训练
拓展培优
真题演练


















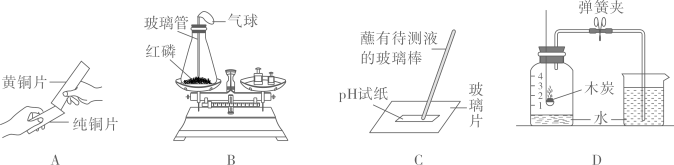
 测定空气中氧气的含量
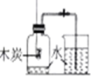
测定空气中氧气的含量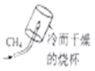 探究甲烷中是否含碳元素
探究甲烷中是否含碳元素 验证质量守恒定律
验证质量守恒定律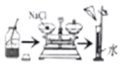 配制一定溶质质量分数的氯化钠溶液
配制一定溶质质量分数的氯化钠溶液