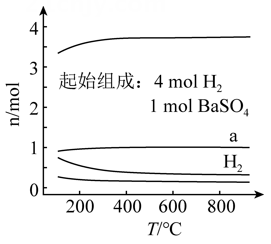
1.
H2O由液态变为气态的过程可以用下式来表示:H2O(l)  H2O(g)。我们也可以用平衡移动原理来解释这一变化中的一些问题,如:H2O的汽化是吸热过程,所以温度升高,平衡向生成更多的H2O(g)的方向移动。若减小压强,平衡向移动。所以高山上由于空气稀薄,水的沸点比平地上(填高或低),高压锅中水的沸点比普通锅中水的沸点(填高或低)。
H2O(g)。我们也可以用平衡移动原理来解释这一变化中的一些问题,如:H2O的汽化是吸热过程,所以温度升高,平衡向生成更多的H2O(g)的方向移动。若减小压强,平衡向移动。所以高山上由于空气稀薄,水的沸点比平地上(填高或低),高压锅中水的沸点比普通锅中水的沸点(填高或低)。
【考点】
化学平衡的影响因素;
化学平衡移动原理;
基础巩固
能力提升
变式训练
拓展培优
真题演练