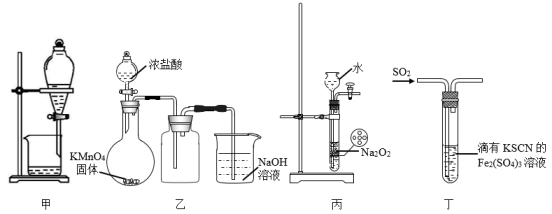
1.
下列实验能达到目的的是( )
实验目的 | 实验操作 | |
A | 验证 | 向盛有 |
B | 实验室制备少量 | 在沸腾的自来水中滴加几滴饱和 |
C | 判断反应后 | 将 |
D | 证明 | 向 |
A.
A
B.
B
C.
C
D.
D
【考点】
性质实验方案的设计;
制备实验方案的设计;
化学实验方案的评价;
能力提升
变式训练
拓展培优