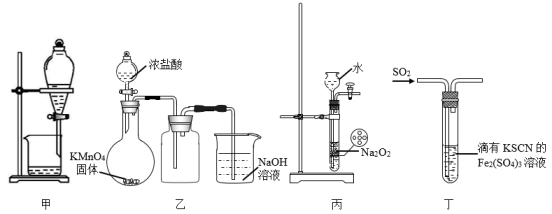
1.
焦亚硫酸钠()是一种食品抗氧化剂,溶于水生成
。
Ⅰ.制备

(1)装置A中盛装亚硫酸钠固体的仪器名称是。
(2)装置B中长颈漏斗的作用是。
(3)试剂X、Y分别是、。(填标号)
a.NaOH溶液 b.饱和溶液
(4)将通入装置C中制得
, 然后再结晶脱水制得
, 写出
生成
的化学方程式:。
Ⅱ.探究的性质
(5)将制得的样品溶于水,得到的溶液分成甲、乙、丙三份,进行实验。实验记录如下:
实验 | 操作 | 现象 |
Ⅰ | 在甲中滴加甲基橙溶液 | 溶液显红色 |
Ⅱ | 在加有少量淀粉的碘水中滴加乙,振荡 | 蓝色溶液变为无色溶液 |
Ⅲ | 在丙中滴加 | 产生白色沉淀 |
①由实验Ⅰ推测溶于水后的溶液显酸性的原因:。
②用离子方程式表示实验Ⅱ中蓝色溶液变为无色溶液的原因:。
③设计实验证明实验Ⅲ中的沉淀成分是还是
或者是二者的混合物:。
【考点】
性质实验方案的设计;
制备实验方案的设计;
化学实验方案的评价;
基础巩固
能力提升
变式训练
拓展培优