1.
小昊在复习了水这一章节后,回到家中观察到家中的水壶也有一层水垢。于是他和化学兴趣小组的同学一起对水壶中的水垢成分进行如下探究。
(1)
(提出问题)水垢的成分是什么?
(2)
(查阅资料)
(3)
(进行实验)加热一段时间后观察到,装置B中,装置C澄清石灰水变浑浊,说明猜想②成立。
(4)
(实验结论)水垢中含有碳酸钙、氢氧化镁
(5)
(实验拓展)小昊从老师那里得知碳酸镁微溶于水,在硬水中也容易形成水垢。于是他又和兴趣小组的同学设计了如图所示的实验装置。
(6)
(分析预测)若水垢中含有碳酸钙、碳酸镁、氢氧化镁,则m的取值范围是。
(知识回顾)水垢主要是硬水煮沸后产生的,生活中常用鉴别硬水。
ⅰ硬水中的碳酸氢钙和碳酸氢镁在沸腾的水里分解生成难溶性的碳酸钙和氢氧化镁沉淀,就形成了水垢。
ⅱ无水硫酸铜遇水变蓝。
ⅲ氢氧化镁高温条件下会分解生成氧化镁和水。
(提出猜想)猜想①:碳酸钙、硫酸镁; 猜想②:碳酸钙、氢氧化镁;
(设计实验)(温馨提示:假设水垢中没有其他成分,所有的反应均反应完全)
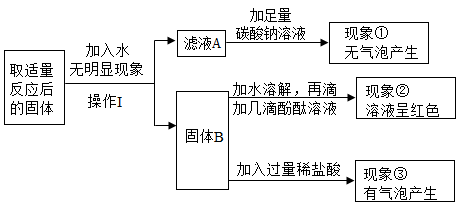
小组讨论后一致认为猜想①不需要实验验证即可否定,其理由是。大家综合考虑后设计实验装置如下。

(反思交流)家用除垢剂原料配方中一般用稀盐酸而不用稀硫酸的原因是。

取10 g水垢样品,加入足量的稀盐酸充分反应,D中固体全部溶解,有气泡产生, 测得反应后F装置质量增加m g。装置F中反应的化学方程式。
【考点】
实验探究物质的组成成分以及含量;
化学实验方案设计与评价;
能力提升
真题演练