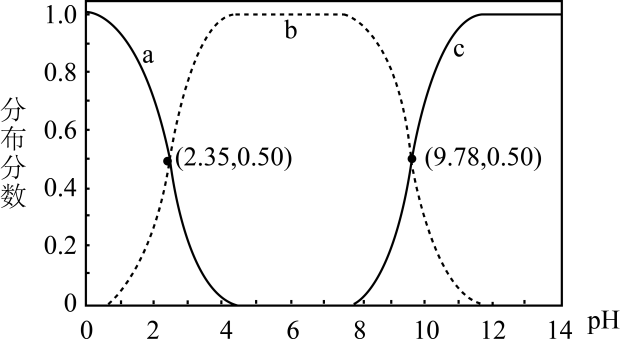
1.
对浓度均为 的①
的① 溶液、②
溶液、② 溶液,下列分析不正确的是
溶液,下列分析不正确的是
A.
①、②中的离子种类相同
B.
 溶于水促进水的电离,而
溶于水促进水的电离,而 抑制水的电离
C.
两种溶液的
抑制水的电离
C.
两种溶液的 大小:①
大小:① ②
D.
①、②均有
②
D.
①、②均有
【考点】
离子浓度大小的比较;